 I. Introduction
I. Introduction
Immunofluorescent staining may be used to rapidly detect viral antigen directly in a clinical specimen. Smears prepared at the patient's bedside may be used, or a smear may be prepared in the laboratory from cellular material in a specimen. Specimens for which direct antigen detection may be requested include bronchoscopy or nasopharyngeal specimens for respiratory virus detection or vesicular lesion scraping for HSV/VZV antigen detection. Cells are stained using pooled or specific monoclonal antibody stains and examined under the fluorescence microscope looking for specific fluorescence of cell cytoplasm or nucleus.
http://bahankuliahkesehatan.blogspot.com/
II. Reagents and Materials
Virus-specific or pooled FITC and Rodamine conjugated antibody stains (with Evans blue counter stain):
Respiratory Viral Screen/RSV panel
FluA/B panel
RSV/para3 panel
Para1,2,3/Adeno panel
Specific Parainfluenza 1
Specific Parainfluenza 2
Herpes simplex 1
Herpes simplex 2
Herpes simplex bivalent
Varicella zoster virus
Phosphate buffered saline (PBS)
Cold acetone (4oC)
Distilled water
FA mounting fluid
Vortex
Sterile pipettes
Cytospin and accessories
Humidified chamber
Coplin jars
Fuorescence microscope with FITC/Rodamine/Evans blue filters
II. Procedure
A. Preparation of slide
a) For swabs:
i. Vortex patient sample in transport medium for 30 seconds.
Remove excess fluid from the swab and discard the swab.
ii. Transfer 0.5 - l.0 ml of this specimen to a microcentrifuge tube. Centrifuge 1 minute at 14,000 rpm.
iii. Remove supernatant (can be placed back with original specimen to be processed further) down to 400 ul (8 drops). Vortex 5-10 seconds.
iv. Pipette 200 ul (4 drops) of this sediment into funnel for each well. Prepare the appropriate number of cytospin wells according to table below.
v. Cytospin at 2000 rpm (700g) for 5 minutes.
vi. Remove slide and air dry.
vii. Fix in cold acetone for 10 minutes in a coplin jar.
viii. Remove slide and air dry.
ix. Proceed to staining. Refer to Appendix V (DFA) for staining procedures.
b) For Bronchoscopy Specimens (BAL,Washings):
i. Mix specimen gently and examine for cellular turbidity. Specimens which are more turbid than a 0.5 McFarland standard are diluted to that approximate turbidity using Hank's Balanced Salt Solution (Gibco BRL).
ii. Pipette 200 ul (4 drops) of specimen into funnel for each well. Prepare the appropriate number of cytospin wells according to table below.
iii. Cytospin 200 uL at 2000 rpm (700 x g) for 5 minutes. Prepare the appropriate number of cytospin preparations according to the table below.
iv. Remove slide and air dry.
v. Fix in cold acetone 10 minutes in coplin jar.
vi. Remove and air dry.
vii. Proceed to staining. Refer to Appendix V (DFA) for staining procedures.
c) For Smears Prepared Outside of the Laboratory
For smears which have been prepared outside of the laboratory, examine macroscopically for evidence of material on slide. Specimens for which only one slide is received may be stained with ONE monoclonal antibody only according to the physician's request. It is not possible to stain a negative control for such specimens. A swab for viral culture should be requested if not received along with the smear.
Draw a circle around material on slide with a diamond pencil prior to staining.
i. Fix in cold acetone 10 minutes in coplin jar.
ii. Remove and air dry
iii. Proceed to staining. Refer to Appendix V (DFA) for staining procedures.
1. Staining Protocol
Prepare appropriate number of cytospin wells and stain as per chart. Refer to Appendix V (DFA) for staining procedures.
| Specimen | Monoclonal Antibody | |
| Nasopharyngeal/ Bronchoscopy/ Throat | Respiratory screen a (November to April) | SimulFluor, Light Diagnostics |
| (prepare 2 cytospin wells) | Flu A/ Flu B | SimulFluor, Light Diagnostics |
| Vesicular Lesion Swab | HSV-bivalent | Bartels |
| (prepare 2 cytospin wells) | | |
| | VZV | Meridan Bioscience Inc. |
a If respiratory screen or Flu A/B is positive, prepare more cytospin preparations and stain according to interpretation chart that follows.
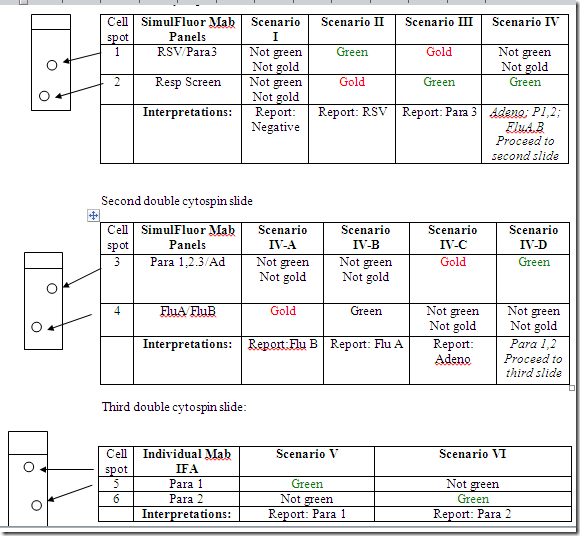
SimulFluor Respiratory Screen Staining Protocol and Interpretations – Scheme 1
Using filter for FITC/Evans Blue (Filter no. 3 in fluorescence microscope no.2, Leica I)
First double-well cytospin slide

SimulFluor Respiratory Screen Staining Protocol and Interpretations- Scheme 2
Using filter for FITC/Evans Blue (Filter no. 3 in fluorescence microscope no.2, Leica I)
First double cytospin slide
III. Interpretation of Results
Examine smear for adequate numbers and types of cells. Respiratory specimens should consist of columnar (ciliated or goblet) epithelial cells. Scrapings from lesions should contain basal epithelial cells. (See reference 2, page 69). Adequate interpretation of results requires a minimum of approximately 20-50 cells per smear. Samples with inadequate numbers of cells should be shown to a charge/senior technologist and reported as having insufficient cellular material.
Positive: Specific, apple-green fluorescence in the cytoplasm and/or nucleus of the exfoliated cells. This specific fluorescence must be absent in the negative control and/or smears stained with other antibodies.
Negative: Dull-red stained cells with no viral specific apple-green fluorescence.
OR
Dull-red stained cells with pinpoint non-specific nuclear staining.
Insufficient cells: Fewer than 20 epithelial cells per smear
IV. Quality Control
Reagent QC:
a. Check expiratory date.
b. Verify that Reagent QC is satisfactory for the reagent lot/kit being used (recorded in Reagent Log and/or on the kit).
c. If necessary, perform the Reagent QC procedure ( external QC slide with all components eg. Bion 14-well Respiratory Panel).
Failed Reagent QC:
Test is invalid without satisfactory Reagent QC results.
a. Do not release reagent lot for use pending resolution of QC error.
b. Inform charge/senior technologist.
c. Record in Reagent Log Chart, Instrument Maintenance Log if microscope/incubator is involved in the failure (and Incident Report if necessary).
d. Re-run failed control materials in parallel to fresh controls to evaluate the QC material itself.
a. If the re-run shows the old QC material still fails and fresh QC is satisfactory, the error may be attributed to the old QC material itself and the reagent is satisfactory.
b. If the re-run shows both the old and fresh QC material fail (or other QC not satisfactory), the error may be attributed to the reagent then the reagent cannot be released for use.
Daily QC:
a. Appropriate positive and negative control slides (eg. ATCC 4-well slide with RSV/Para3 for SimulF RS stain) should be stained with each batch.
b. Examine the negative control well first to establish the dull red colour (Evans blue counterstained) and to determine if there is any nonspecific staining.
The positive control must be clearly distinguishable from the negative control or the test is invalid.
Failed Daily QC:
a. Do not release patient results pending resolution of QC error.
b. Inform charge/senior technologist.
c. Record in Reagent Log Chart (and Instrument Maintenance Log if microscope/incubator is causing the failure).
d. Re-run failed controls in parallel to fresh controls (and/or external QC) to evaluate the QC material itself.
e. If the re-run shows the old QC material still fails and fresh QC passes and nothing else is wrong with the batch (only the old QC material failed, patient results valid) patient results may be released.
Marked decrease/absence in fluorescence can be due to:
a. Reagent deterioration/skipping (did not apply the correct stain)
b. Microscope (filter, bulb, alignment)
c. Other equipment, reagents or technique
V. Reporting
See individual specimen protocols.
VI. Reference
1. Wiedbrauk, D.L. 1993, Raven Press. Manual of Clinical Virology.
2. Rossier, E., Miller, H., Phipps, P. 1989, University of Ottawa Press. Rapid Viral
Diagnosis by Immunofluorescence: An Atlas & Practical Guide.
3. SimulFluor Product Insert for cat. no. 3296, June 2002, Revision C: 40729
Light Diagnostics Chemicon International Temecula, CA 92590
http://bahankuliahkesehatan.blogspot.com/
BAHAN KULIAH DAN MAKALAH KESEHATAN : http://bahankuliahkesehatan.blogspot.com/2011/08/direct-antigen-detection-from-specimens.html









































